Nome: Turma:
Exercícios de revisão para o ED
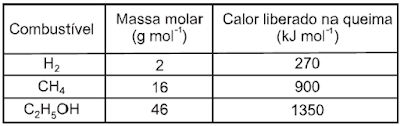
1)
Vários
combustíveis alternativos estão sendo procurados para reduzir a demanda por
com-bustíveis fósseis, cuja queima prejudica o meio ambiente devido à produção
de dióxido de carbono (massa molar igual a 44 g mol–1).Três dos mais promissores combustíveis alternativos são o hidrogênio, o etanol e
o metano. A queima de 1 mol de cada um
desses combustíveis
libera uma determinada quantidade de
calor, que estão
apresentadas na tabela a seguir.
2)
Considere que foram
queimadas massas, independentemente, desses três combustíveis, de forma tal que
em cada queima foram liberados 2700 kJ. O
combustível mais econômico, ou seja, o que teve a menor massa consumida, e o
combustível mais poluente, que é aquele que produziu a maior massa de dióxido
de carbono (massa molar igual a 44 g mol–1), foram, respectivamente:
a)
o etanol, que teve apenas 23 g de massa consumida, e o metano,
que produziu 450 g de CO2.
b)
o hidrogênio, que teve apenas 20 g de massa consumida, e o
etanol, que produziu 176 g de CO2.
c)
o hidrogênio,que teve apenas 20 g de massa consumida, e o
metano, que produziu 132 g de CO2.
d) o etanol, que teve
apenas 48 g de massa consumida, e o metano, que produziu 88 g de CO2.
e) o hidrogênio, que teve apenas 2 g de
massa consumida, e o etanol, que produziu 725 g de CO2.
2) No que tange à tecnologia de combustíveis alternativos, muitos
especialistas em energia acreditam que os alcoóis vão crescer em importância em
um futuro próximo. Realmente, alcoóis como metanol e etanol têm encontrado
alguns nichos para uso doméstico como combustíveis há muitas décadas e,
recentemente, vêm obtendo uma aceitação cada vez maior como aditivos ou mesmo
como substitutos para a gasolina em veículos. Algumas das propriedades físicas
desses combustíveis são mostradas no quadro seguinte.
Dados: Massas molares em
g/mol: H = 1,0; C = 12,0; O = 16,0.
Considere que, em pequenos volumes, o
custo de produção de ambos os alcoóis seja o mesmo. Dessa forma, do ponto de
vista econômico, é mais vantajoso utilizar:
a) metanol, pois sua
combustão completa fornece, aproximadamente, 22,7 kJ de energia por litro de
combustível queimado.
b) etanol, pois sua
combustão completa fornece, aproximadamente, 29,7 kJ de energia por litro de
combustível queimado.
c) metanol, pois sua
combustão completa for-nece, aproximadamente, 17,9 MJ de energia por litro de
combustível queimado
d) etanol, pois sua
combustão completa forne-ce, aproximadamente, 23,5 MJ de energia por litro de combustível
queimado.
e) etanol, pois sua
combustão completa forne-ce, aproximadamente, 33,7 MJ de energia por litro de
combustível queimado.
3) O urânio é um elemento cujos átomos
contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U
é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por
nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia
(2,35x1010 KJ/mol). O isótopo 235U ocorre naturalmente em
minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na
geração de energia nuclear, o minério é submetido a um processo de
enriquecimento, visando aumentar a concentração do isótopo 235U
para, aproximadamente, 3% nas pastilhas.
Em décadas anteriores, houve um movimento mundial para aumentar a
geração de energia nuclear buscando substituir, parcialmente, a geração de
energia elétrica a partir da queima do carvão, o que diminui a emissão
atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima
do carvão é representada pela equação química:
Qual é a massa
de CO2, em toneladas, que deixa de ser liberada na atmosfera, para
cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao
carvão como fonte de energia?
a)
2,10 b) 7,70 c) 9,00 d) 33,0 e) 300
4) O ferro é encontrado
na natureza na forma de seus minérios, tais como a hematita (α-Fe2O3),
a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o
ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em
condições adequadas. Uma das etapas nesse processo é a formação de monóxido de
carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a
equação química:
Considere as seguintes equações
termoquímicas:
O valor mais próximo de ΔHӨ,
em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é:
a)
-14 ; b)
-17; c)-50; d) -64; e)-100
5) O benzeno, um importante solvente para a indústria
química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela
trimerização do acetileno catalisada por ferro metálico sob altas temperaturas,
conforme a equação química:
3 C2H2
(g) → C6H6 (l)
A energia envolvida nesse processo pode
ser calculada indiretamente pela variação de entalpia das reações de combustão
das substâncias participantes, nas mesmas condições experimentais:
A variação de entalpia do processo de
trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de:
A) –1090. B) –150. C)
–50 D) +157. E) +470.
.
Observação: As alternativas de cada questão são apenas para
orientar o aluno para, após realizar os cálculos das questões, encontrar a
alternativa que corresponda com o raciocínio descrito na sua resolução. Sem o
raciocínio da questão explicitada na resolução não há como certificar se houve
aprendizagem.



Nenhum comentário:
Postar um comentário